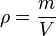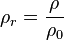La naturaleza nunca va a alterar su composicion original.
MUSIC
miércoles, 6 de octubre de 2010
LEY DE PROUST
En 1808 Proust llego a la conclucion que paraformar un determinado compuesto, dos o mas elementos quimicos se unen en la misma proporcion ponderal.
La naturaleza nunca va a alterar su composicion original.

La naturaleza nunca va a alterar su composicion original.
COLOIDES Y SUSPENCIONES
COLOIDES
es un sistema físico-químico formado por dos o más fases, principalmente éstas son: una continua, normalmente fluida, y otra dispersa en forma de partículas; por lo general sólidas.
La fase dispersa es la que se halla en menor proporción.
El nombre de coloide proviene de la raíz griega kolas que significa que puede pegarse. Este nombre hace referencia a una de las principales propiedades de los coloides: su tendencia espontánea a agregar o formar coágulos.
Aunque el coloide por excelencia es aquel en el que la fase continua es un líquido y la fase dispersa se compone de partículas sólidas, pueden encontrarse coloides cuyos componentes se encuentran en otros es
tados de agregación.
SUSPENCIONES
son mezclas heterogéneas formadas por un sólido en polvo (soluto) o pequeñas partículas no solubles (fase dispersa) que se dispersan en un medio líquido o gaseoso (fase dispersante o dispersora). Cuando uno de los componentes es agua y los otros son sólidos suspendidos en la mezcla, son conocidas como suspensiones mecánicas.
Ejemplos de suspensiones son:
es un sistema físico-químico formado por dos o más fases, principalmente éstas son: una continua, normalmente fluida, y otra dispersa en forma de partículas; por lo general sólidas.
La fase dispersa es la que se halla en menor proporción.
El nombre de coloide proviene de la raíz griega kolas que significa que puede pegarse. Este nombre hace referencia a una de las principales propiedades de los coloides: su tendencia espontánea a agregar o formar coágulos.
Aunque el coloide por excelencia es aquel en el que la fase continua es un líquido y la fase dispersa se compone de partículas sólidas, pueden encontrarse coloides cuyos componentes se encuentran en otros es
| Fase dispersa | ||||
|---|---|---|---|---|
| Fase continua | Gas | No es posible porque todos los gases son solubles entre sí | Aerosol líquido,Ejemplos: niebla, bruma | Aerosol sólido,Ejemplos: Humo, polvo en suspensión |
| Líquido | Espuma,Ejemplos: Espuma de afeitado | Emulsión,Ejemplos: Leche, salsa mayonesa, crema de manos, sangre | Sol,Ejemplos: Pinturas, tinta china | |
| Sólido | Espuma Sólida,Ejemplos: piedra Pómez, Aerogeles | Gel,Ejemplos: Gelatina, gominola, queso | Sol sólido,Ejemplos: Cristal de Rubí | |
tados de agregación.
SUSPENCIONES
son mezclas heterogéneas formadas por un sólido en polvo (soluto) o pequeñas partículas no solubles (fase dispersa) que se dispersan en un medio líquido o gaseoso (fase dispersante o dispersora). Cuando uno de los componentes es agua y los otros son sólidos suspendidos en la mezcla, son conocidas como suspensiones mecánicas.
Características
Las suspensiones presentan las siguientes características: MLP m.- Sus partículas son mayores que las de las disoluciones y los coloides, lo que permite observarlas a simple vista.
- Sus partículas se sedimentan si la suspensión se deja en reposo.
Ejemplos de suspensiones son:
- algunos medicamentos;
- agua y la arena;
- la arena mezclada con el cemento;
- refrescos elaborados con zumos de frutas;
- algunas pinturas vinílicas.
- algunos aerosoles, especialmente aquellos que requieren ser agitados antes de usarse.
- el aceite diluido con el agua.
| Fase dispersa | ||||
|---|---|---|---|---|
| Fase continua | Gas | No es posible porque todos los gases son solubles entre sí | Aerosol líquido,Ejemplos: niebla, bruma | Aerosol sólido,Ejemplos: Humo, polvo en suspensión |
| Líquido | Espuma,Ejemplos: Espuma de afeitado | Emulsión,Ejemplos: Leche, salsa mayonesa, crema de manos, sangre | Sol,Ejemplos: Pinturas, tinta china | |
| Sólido | Espuma Sólida,Ejemplos: piedra Pómez, Aerogeles | Gel,Ejemplos: Gelatina, gominola, queso | Sol sólido,Ejemplos: Cristal de Rubí | |
METODOS DE SEPARACION
Sabemos que la mezcla es la unión física de dos o más substancias (elementos o compuestos) que al hacerlo conservan sus propiedades individuales y que existen mezclas homogéneas y heterogéneas. La composición de las mezclas es variable y sus componentes podrán separarse por medios físicos o mecánicos.
LA DECANTACIÓN. Es un método utilizado para separar un sólido, de grano grueso e insoluble, de un líquido. Consiste en esperar que se sedimente el sólido para poder vaciar el líquido en otro recipiente.

DECANTACIÓN DE LÍQUIDOS. Este método se utiliza para la separación de dos líquidos no miscibles y de diferentes densidades, utilizando un embudo de decantación. Este método es aplicado en la extracción de petróleo en yacimientos marinos la cual separan el petróleo, al ser menos denso, quedando en la parte superior del agua. El petróleo se almacena y el agua es devuelta al mar.

LA FILTRACIÓN. Con este método se puede separar un sólido insoluble de grano relativamente fino de un líquido. En este método es indispensable un medio poroso de filtración que deja pasar el líquido y retiene el sólido. Los filtros más comunes son: papel filtro, redes metálicas, fibra de asbesto, fibra de vidrio, algodón fibras vegetales y tierras especiales.

LA FILTRACIÓN POR VACIO. Es una operación como la anterior, sólo que ahora interviene un matraz quitazato, una bomba de vacío para extraer aire y conseguir asvacío un filtrado en el menor tiempo. Un ejemplo muy común de filtración es aplicado en los automóviles en la gasolina que llevan un filtro con papel y en el aceite que puede ser de papel como filtros GONNER o red metálica como el VW ).

LA CENTRIFUGACIÓN. Es un método utilizado para separar un sólido insoluble de grano muy fino y de difícil sedimentación de un líquido. Esta operación se lleva a cabo en un aparato llamado centrífuga, en el que aumenta la fuerza gravitación provocando la sedimentación del sólido.El plasma de la sangre puede separarse por este método.

DESTILACIÓN. Este método permite separar mezclas de líquidos miscibles, aprovechando sus diferentes puntos de ebullición. Un ejemplo sencillo es separar una mezcla de agua y alcohol el cual no se puede decantar y es mas apropiado destilarlo, colocando la mezcla en un matraz de destilación, el cual estará conectado a un refrigerante (con circulación de agua) y todo este sistema sujetado por pinzas a los soportes universales. En la parte superior del matraz un termómetro para controlar la temperatura y en la parte inferior un anillo con una tela con asbesto para homogenizar la temperatura que tendrá en la parte inferior por el mechero de bunsen.
Al calentar de manera controlada el alcohol se evaporará primero y al pasar por el refrigerante se condensara y volverá a estado líquido para recuperarlo al final del recipiente en un vaso de precipitados. Otro ejemplo es por destilación fraccionada y en grandes torres se efectúa la separación de los hidrocarburos del petróleo. Por destilación con arrastre de vapor se separa el solvente que extrae el aceite de las semillas, por ejemplo, hexano que extrae el aceite de ajonjolí. También de esta forma se extrae esencias como la de anís o de orégano.
Al calentar de manera controlada el alcohol se evaporará primero y al pasar por el refrigerante se condensara y volverá a estado líquido para recuperarlo al final del recipiente en un vaso de precipitados. Otro ejemplo es por destilación fraccionada y en grandes torres se efectúa la separación de los hidrocarburos del petróleo. Por destilación con arrastre de vapor se separa el solvente que extrae el aceite de las semillas, por ejemplo, hexano que extrae el aceite de ajonjolí. También de esta forma se extrae esencias como la de anís o de orégano.

CRISTALIZACIÓN. Con este método se provoca la separación de un sólido que se encuentra disuelto en una solución quedando el sólido como cristal y en este proceso involucra cambios de temperatura, agitación, eliminación del solvente, etc. Por este método se obtiene azúcar, productos farmacéuticos, reactivos para laboratorio (sales), etc.

EVAPORACIÓN. Con este método se separa un sólido disuelto en un líquido y consiste en aplicar incremento de temperatura hasta que el líquido hierve y pasa del estado líquido a estado de vapor, quedando el sólido como residuo en forma de polvo seco. El líquido puede o no recuperarse.

SUBLIMACIÓN. Método utilizado en la separación de sólidos, aprovechando que alguno de ellos es sublimable, pasa de manera directa del estado sólido al gaseoso por incremento de temperatura.

CROMATOGRAFÍA. Este método consiste en separar mezclas de gases o líquidos, pasando la solución o muestra a través de un medio poroso y adecuado, con la ayuda de un solvente determinado.
El equipo para esta operación puede ser tan simple como una columna rellena, un papel o una placa que contienen el medio poroso, o bien un cromatógrafo. Por este proceso se analizan mezclas como aire, productos extraídos de plantas y animales, productos elaborados como tintas, lápices labiales, etc. Un ejemplo sencillo se puede hacer con un gis y agua. En la parte media del gis se hace una marca de tinta (plumón) y luego se coloca el gis en agua sin que ésta llegue a la marca. Después de un tiempo se verán los componentes de la tinta.
El equipo para esta operación puede ser tan simple como una columna rellena, un papel o una placa que contienen el medio poroso, o bien un cromatógrafo. Por este proceso se analizan mezclas como aire, productos extraídos de plantas y animales, productos elaborados como tintas, lápices labiales, etc. Un ejemplo sencillo se puede hacer con un gis y agua. En la parte media del gis se hace una marca de tinta (plumón) y luego se coloca el gis en agua sin que ésta llegue a la marca. Después de un tiempo se verán los componentes de la tinta.

IMANTACIÓN. Con este método se aprovecha la propiedad de algún material para ser atraído por un campo magnético. Los materiales ferrosos pueden ser separados de otros componentes por medio de un electroimán, para su tratamiento posterior.

DIFERENCIA DE SOLUBILIDAD. Permite separar sólidos de líquidos o líquidos de líquidos al contacto con un solvente que selecciona uno de los componentes de la mezcla. Este componente es soluble en el solvente adecuado y es arrastrado para la separación ya sea por decantación, filtración vaporización, destilación, etc., dejándolo en estado puro. Es muy común en la preparación y análisis de productos farmacéuticos.

DEFINICIONES
ELEMENTO: es un tipo de materia, constituida por átomos de la misma clase. En su forma más simple posee un número determinado de protones en su núcleo, haciéndolo pertenecer a una categoría única clasificada con el número atómico, aun cuando este pueda ostentar distintas masas atómicas.
COMPUESTO:es una sustancia formada por la unión de dos o más elementos de la tabla periódica, en una razón fija. Una característica esencial es que tiene una fórmula química. Por ejemplo, el agua es un compuesto formado por hidrógeno y oxígeno en la razón de 2 a 1 (en número de átomos).
DISOLUCION: es mezcla homogenea a nivel molecular o ionico de dos o mas especies quimicas que no reaccionanentre si cuyos componentes se encuentran en proporcion que varia entre ciertos limites.
TEMPERATURA: es una magnitud referida a las nociones comunes de caliente o frío. Por lo general, un objeto más "caliente" tendrá una temperatura mayor, y si fuere frío tendrá una temperatura menor. Físicamente es una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica.
SOLVATACION:es el proceso de asociación de moléculas de un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvenTe. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.
DENSIDAD:
La densidad o densidad absoluta es la magnitud que expresa la relación entre la masa y el volumen de un cuerpo. Su unidad en el Sistema Internacional es el kilogramo por metro cúbico (kg/m3), aunque frecuentemente se expresa en g/cm3. La densidad es una magnitud intensiva
Para los líquidos y los sólidos, la densidad de referencia habitual es la del agua líquida a la presión de 1 atm y la temperatura de 4 °C. En esas condiciones, la densidad absoluta del agua destilada es de 1000 kg/m3, es decir, 1 kg/L.
Para los gases, la densidad de referencia habitual es la del aire a la presión de 1 atm y la temperatura de 0 C.
MISCIBILIDAD: se refiere a la propiedad de algunos líquidos para mezclarse en cualquier proporción, formando una solución homogénea. En principio, el término es también aplicado a otras fases (sólidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro.
COMPUESTO:es una sustancia formada por la unión de dos o más elementos de la tabla periódica, en una razón fija. Una característica esencial es que tiene una fórmula química. Por ejemplo, el agua es un compuesto formado por hidrógeno y oxígeno en la razón de 2 a 1 (en número de átomos).
DISOLUCION: es mezcla homogenea a nivel molecular o ionico de dos o mas especies quimicas que no reaccionanentre si cuyos componentes se encuentran en proporcion que varia entre ciertos limites.
TEMPERATURA: es una magnitud referida a las nociones comunes de caliente o frío. Por lo general, un objeto más "caliente" tendrá una temperatura mayor, y si fuere frío tendrá una temperatura menor. Físicamente es una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica.
SOLVATACION:es el proceso de asociación de moléculas de un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvenTe. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.
DENSIDAD:
La densidad o densidad absoluta es la magnitud que expresa la relación entre la masa y el volumen de un cuerpo. Su unidad en el Sistema Internacional es el kilogramo por metro cúbico (kg/m3), aunque frecuentemente se expresa en g/cm3. La densidad es una magnitud intensiva
donde ρ es la densidad, m es la masa y V es el volumen del determinado cuerpo.
Densidad relativa
La densidad relativa de una sustancia es la relación existente entre su densidad y la de otra sustancia de referencia; en consecuencia, es una magnitud adimensional (sin unidades)
donde ρr es la densidad relativa, ρ es la densidad de la sustancia, y ρ0 es la densidad de referencia o absoluta.
Para los líquidos y los sólidos, la densidad de referencia habitual es la del agua líquida a la presión de 1 atm y la temperatura de 4 °C. En esas condiciones, la densidad absoluta del agua destilada es de 1000 kg/m3, es decir, 1 kg/L.
Para los gases, la densidad de referencia habitual es la del aire a la presión de 1 atm y la temperatura de 0 C.
MISCIBILIDAD: se refiere a la propiedad de algunos líquidos para mezclarse en cualquier proporción, formando una solución homogénea. En principio, el término es también aplicado a otras fases (sólidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro.
CAPACIDAD DE DISOLUCION DEL AGUA
El agua es el disolvente universal.
Todo soluto se disuelve en el agua que no tenga mayor densidad a ella.
Los atomos se mesclan y pueden ser separados por metodos de separacion como la destilacion, ademas es el unico que se puede encontrar en todos los estados de la materia que son:
SOLIDO: En este caso resultan ser las vibraciones de las particulas en sus sitios dentro del solido opone resistencia a cambios de forma y de volumen.
LIQUIDO: Un fluido cuyo volumen es constante en condiciones de temperatura y presion constantes y su forma es esferica.
GASEOSO: No tiene forma ni volumen propio. Con moleculas no unidas, expandidas y con poca fuerzade atraccion haciendo que no tenga volumen ni forma definida
Todo soluto se disuelve en el agua que no tenga mayor densidad a ella.
Los atomos se mesclan y pueden ser separados por metodos de separacion como la destilacion, ademas es el unico que se puede encontrar en todos los estados de la materia que son:
SOLIDO: En este caso resultan ser las vibraciones de las particulas en sus sitios dentro del solido opone resistencia a cambios de forma y de volumen.
LIQUIDO: Un fluido cuyo volumen es constante en condiciones de temperatura y presion constantes y su forma es esferica.
GASEOSO: No tiene forma ni volumen propio. Con moleculas no unidas, expandidas y con poca fuerzade atraccion haciendo que no tenga volumen ni forma definida
PROPIEDADES FISICAS Y QUIMICAS DEL AGUA
FISICAS
Estado físico: sólida, liquida y gaseosa
Color: incolora
Sabor: insípida
Olor: inodoro
Densidad: 1 g./c.c. a 4°C
Punto de congelación: 0°C
Punto de ebullición: 100°C
Presión critica: 217,5 atm.
Temperatura critica: 374°C
QUIMICAS
Reacciona con los óxidos ácidos
Reacciona con los óxidos básicos
Reacciona con los metales
Reacciona con los no metales
Se une en las sales formando hidratos
Estado físico: sólida, liquida y gaseosa
Color: incolora
Sabor: insípida
Olor: inodoro
Densidad: 1 g./c.c. a 4°C
Punto de congelación: 0°C
Punto de ebullición: 100°C
Presión critica: 217,5 atm.
Temperatura critica: 374°C
QUIMICAS
Reacciona con los óxidos ácidos
Reacciona con los óxidos básicos
Reacciona con los metales
Reacciona con los no metales
Se une en las sales formando hidratos
TENSION SUPERFICIAL
En fisica se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esta definición implica que el líquido tiene una resistencia para aumentar su superficie. Este efecto permite a algunos insectos, como el zapatero, desplazarse por la superficie del agua sin hundirse. La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad.
¿COMO SE CONTAMINA EL AGUA?
. Debido a su ubicación, esta agua se contamina por los residuos cloacales que se infiltran a través del suelo; con materiales provenientes de basurales, que se escurren con el agua de riego.
El proceso natural que se produce para eliminar los contaminantes, llamado autodepuración, es más lento en las aguas subterráneas que en las superficiales. Debido a que las napas subterráneas constituyen una de las reservas de agua dulce de nuestro planeta, es muy importante cuidarlas y evitar su contaminación.
Los principales contaminantes del agua son los siguientes:
Aguas residuales y otros residuos que demandan oxígeno (en su mayor parte materia orgánica, cuya descomposición produce la desoxigenación del agua).
Agentes infecciosos.
Nutrientes vegetales que pueden estimular el crecimiento de las plantas acuáticas. Éstas, a su vez, interfieren con los usos a los que se destina el agua y, al descomponerse, agotan el oxígeno disuelto y producen olores desagradables.
Productos químicos, incluyendo los pesticidas, diversos productos industriales, las sustancias tensioactivas contenidas en los detergentes, y los productos de la descomposición de otros compuestos orgánicos.
Petróleo, especialmente el procedente de los vertidos accidentales.
Minerales inorgánicos y compuestos químicos.
Sedimentos formados por partículas del suelo y minerales arrastrados por las tormentas y escorrentías desde las tierras de cultivo, los suelos sin protección, las explotaciones mineras, las carreteras y los derribos urbanos.
Sustancias radiactivas procedentes de los residuos producidos por la minería y el refinado del uranio y el torio, las centrales nucleares y el uso industrial, médico y científico de materiales radiactivos.
El calor también puede ser considerado un contaminante cuando el vertido del agua empleada para la refrigeración de las fábricas y las centrales energéticas hace subir la temperatura del agua de la que se abastecen.
El proceso natural que se produce para eliminar los contaminantes, llamado autodepuración, es más lento en las aguas subterráneas que en las superficiales. Debido a que las napas subterráneas constituyen una de las reservas de agua dulce de nuestro planeta, es muy importante cuidarlas y evitar su contaminación.
Los principales contaminantes del agua son los siguientes:
Aguas residuales y otros residuos que demandan oxígeno (en su mayor parte materia orgánica, cuya descomposición produce la desoxigenación del agua).
Agentes infecciosos.
Nutrientes vegetales que pueden estimular el crecimiento de las plantas acuáticas. Éstas, a su vez, interfieren con los usos a los que se destina el agua y, al descomponerse, agotan el oxígeno disuelto y producen olores desagradables.
Productos químicos, incluyendo los pesticidas, diversos productos industriales, las sustancias tensioactivas contenidas en los detergentes, y los productos de la descomposición de otros compuestos orgánicos.
Petróleo, especialmente el procedente de los vertidos accidentales.
Minerales inorgánicos y compuestos químicos.
Sedimentos formados por partículas del suelo y minerales arrastrados por las tormentas y escorrentías desde las tierras de cultivo, los suelos sin protección, las explotaciones mineras, las carreteras y los derribos urbanos.
Sustancias radiactivas procedentes de los residuos producidos por la minería y el refinado del uranio y el torio, las centrales nucleares y el uso industrial, médico y científico de materiales radiactivos.
El calor también puede ser considerado un contaminante cuando el vertido del agua empleada para la refrigeración de las fábricas y las centrales energéticas hace subir la temperatura del agua de la que se abastecen.
lunes, 4 de octubre de 2010
HIDROGENO Y OXIGENO
HIDROGENO
Gas incoloro, inodoro e insípido, compuesto de moléculas diatómicas, H2.Es uno de los constituyentes principales del agua y de toda la materia orgánica, y está distribuido de manera amplia no sólo en la Tierra sino en todo el universo. Existen 3 isótopos del hidrógeno: el protio, de masa 1, que se encuentra en más del 99.98% del elemento natural; el deuterio, de masa 2, que se encuentra en la naturaleza aproximadamente en un 0.02%, y el tritio, de masa 3, que aparece en pequeñas cantidades en la naturaleza, pero que puede producirse artificialmente por medio de varias reacciones nucleares. Usos: El empleo más importante del hidrógeno es en la síntesis del amoniaco. La utilización del hidrógeno está aumentando con rapidez en las operaciones de refinación del petróleo, como el rompimiento por hidrógeno (hydrocracking), y en el tratamiento con higrógeno para eliminar azufre. Se consumen grandes cantidades de hidrógeno en la hidrogenación catalítica de aceites vegetales líquidos insaturados para obtener grasas sólidas. La hidrogenación se utiliza en la manufactura de productos químicos orgánicos. Grandes cantidades de hidrógeno se emplean como combustible de cohetes, en combinación con oxígeno o flúor, y como un propulsor de cohetes impulsados por energía nuclear.
OXIGENO
Gas incoloro e inodoro, formando parte del aire atmosférico en un 20,95 % vol. Al ser intensamente oxidante, debe evitarse todo contacto con sustancias fácilmente combustibles, ya que pueden provocar su inflamación. Todos los accesorios y elementos que puedan entrar en contacto con el oxígeno deben estar exentos de grasa, aceites y lubricantes. USOS: Oxicorte y soldadura. Corte Láser. Combustión. Industría química. Tratamiento de superficies con llama. Tratamiento de aguas residuales. Piscicultura. Producción de Ozono.
ELECTRÓLISIS
La electrólisis o electrolisis es un método de separación de los elementos que forman un compuesto aplicando electricidad: se produce en primer lugar la descomposición en iones, seguido de diversos efectos o reacciones secundarios según los casos concretos.
Electrólisis procede de dos radicales, electro que hace referencia a electricidad y lisis que quiere decir rotura.
El proceso electrolítico consiste en lo siguiente. Se disuelve una sustancia en un determinado disolvente, con el fin de que los iones que constituyen dicha sustancia estén presentes en la disolución. Posteriormente se aplica una corriente eléctrica a un par de electrodos conductores colocados en la disolución. El electrodo cargado negativamente se conoce como cátodo, y el cargado positivamente como ánodo. Cada electrodo atrae a los iones de carga opuesta. Así, los iones positivos, o cationes, son atraídos al cátodo, mientras que los iones negativos, o aniones, se desplazan hacia el ánodo. La energía necesaria para separar a los iones e incrementar su concentración en los electrodos, proviene de una fuente de potencia eléctrica que mantiene la diferencia de potencial en los electrodos.
En los electrodos, los electrones son absorbidos o emitidos por los iones, formando concentraciones de los elementos o compuestos deseados. Por ejemplo, en la electrólisis del agua, se forma hidrógeno en el cátodo, y oxígeno en el ánodo. Esto fue descubierto en 1820 por el físico y químico inglés Michael Faraday.
La electrólisis no depende de la transferencia de calor, aunque éste puede ser producido en un proceso electrolítico, por tanto, la eficiencia del proceso puede ser cercana al 100%.
Electrólisis procede de dos radicales, electro que hace referencia a electricidad y lisis que quiere decir rotura.
El proceso electrolítico consiste en lo siguiente. Se disuelve una sustancia en un determinado disolvente, con el fin de que los iones que constituyen dicha sustancia estén presentes en la disolución. Posteriormente se aplica una corriente eléctrica a un par de electrodos conductores colocados en la disolución. El electrodo cargado negativamente se conoce como cátodo, y el cargado positivamente como ánodo. Cada electrodo atrae a los iones de carga opuesta. Así, los iones positivos, o cationes, son atraídos al cátodo, mientras que los iones negativos, o aniones, se desplazan hacia el ánodo. La energía necesaria para separar a los iones e incrementar su concentración en los electrodos, proviene de una fuente de potencia eléctrica que mantiene la diferencia de potencial en los electrodos.
En los electrodos, los electrones son absorbidos o emitidos por los iones, formando concentraciones de los elementos o compuestos deseados. Por ejemplo, en la electrólisis del agua, se forma hidrógeno en el cátodo, y oxígeno en el ánodo. Esto fue descubierto en 1820 por el físico y químico inglés Michael Faraday.
La electrólisis no depende de la transferencia de calor, aunque éste puede ser producido en un proceso electrolítico, por tanto, la eficiencia del proceso puede ser cercana al 100%.
Suscribirse a:
Entradas (Atom)