El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico
vero quimica
Solo para la materia de QUIMICA
MUSIC
lunes, 29 de noviembre de 2010
Enlace covalente polar
En la mayoría de los enlaces covalentes, los átomos tienen diferentes electronegatividades, y como resultado, un átomo tiene mayor fuerza de atracción por el par de electrones compartido que el otro átomo. En general, cuando se unen dos átomos no metálicos diferentes, los electrones se comparten en forma desigual. Un enlace covalente en el que los electrones se comparten desigualmente se denomina enlace covalente polar .
El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico
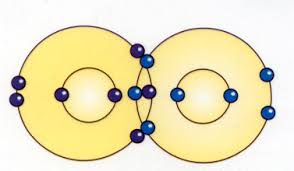
El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico
Enlace covalente no polar
El hidrogeno es el primer elemento que presenta este tipo de enlace, por ejemplo cuando dos átomos comparten sus electrones, ambos adquieren la configuración del helio: 1s²
H + H --> H:H
Átomo de hidrogeno átomo de hidrogeno electrones compartidos
Se deduce entonces que un enlace covalente no polar, es aquel que se lleva acabo cuando se unen dos átomos iguales; y por lo mismo con la misma electronegatividad.
Ejemplo: el enlace covalente en le F2 cada átomo de flúor pose sus electrones propios y comparte otros dos, suficiente para completar los ocho que tiene el neón en su ultimo nivel energético. Los electrones más internos se omiten y solo se representa la compartición de los externos y se simplifica cuando únicamente se representa el enlace compartido por una línea de enlace.
Enlace quimico
Es la fuerza existente dos o mas átomos que los mantiene unidos en las moléculas.
Al producirse un acercamiento entre dos o mas átomos , puede darse una fuerza de atracción entre los electrones de los átomos y el núcleo de uno u otro atomo.

Al producirse un acercamiento entre dos o mas átomos , puede darse una fuerza de atracción entre los electrones de los átomos y el núcleo de uno u otro atomo.
Energia de ionizacion
Se define como la cantidad mínima de energía que hay que suministrar a un átomo neutro gaseoso y en estado fundamental para arrancarle el e- enlazado con menor fuerza, es decir, mide la fuerza con la que está unido el e- al átomo.
Es una energía muy elevada para los gases nobles y es necesaria una mayor cantidad de energía.
Las energías de ionización pequeña indican que los e- se arrancan con facilidad.
A medida que aumenta n el e- está más lejos del núcleo, la atracción es menor y por lo tanto, la energía de ionización es menor.
En el mismo periodo aumenta la carga nuclear y la energía de ionización tiene valores más grandes

Es una energía muy elevada para los gases nobles y es necesaria una mayor cantidad de energía.
Las energías de ionización pequeña indican que los e- se arrancan con facilidad.
A medida que aumenta n el e- está más lejos del núcleo, la atracción es menor y por lo tanto, la energía de ionización es menor.
En el mismo periodo aumenta la carga nuclear y la energía de ionización tiene valores más grandes
Afinidad electronica
La cantidad de energia que se libera cuando un atomo aislado se le adiciona un electron.
Se define como la variación de energía que tiene lugar cuando un átomo en estado gaseoso adquiere un e-.
Cuando el F adquiere un e- se libera energía, es un proceso exotérmico y la afinidad electrónica tiene un valor negativo.
Si el valor negativo es alto, estos átomos ganan con facilidad e-.
La afinidad electrónica y la energía de ionización varían igual en la tabla periódica.

Se define como la variación de energía que tiene lugar cuando un átomo en estado gaseoso adquiere un e-.
Cuando el F adquiere un e- se libera energía, es un proceso exotérmico y la afinidad electrónica tiene un valor negativo.
Si el valor negativo es alto, estos átomos ganan con facilidad e-.
La afinidad electrónica y la energía de ionización varían igual en la tabla periódica.

Radio atomico
Esta definido como mitad de la distancia entre dos núcleos de dos átomos adyacentes. Diferentes propiedades físicas, densidad, punto de fusión, punto de ebullición, estos están relacionadas con el tamaño de los átomos.


Electronegatividad
Es una medida de la fuerza de atracción que ejerce un átomo sobre los electrones de otro en un enlace covalente. Los diferentes valores de electronegatividad se clasifican según diferentes escalas, entre ellas la escala de Pauling y la escala de Mulliken.

En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina. Así, según la diferencia entre las electronegatividades de éstos se puede determinar (convencionalmente) si el enlace será, según la escala de Linus Pauling:
- Iónico (diferencia superior o igual a 1.7)
- Covalente polar (diferencia entre 1.7 y 0.4)
- Covalente no polar (diferencia inferior a 0.4)

Suscribirse a:
Entradas (Atom)