El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico
MUSIC
lunes, 29 de noviembre de 2010
Enlace covalente polar
En la mayoría de los enlaces covalentes, los átomos tienen diferentes electronegatividades, y como resultado, un átomo tiene mayor fuerza de atracción por el par de electrones compartido que el otro átomo. En general, cuando se unen dos átomos no metálicos diferentes, los electrones se comparten en forma desigual. Un enlace covalente en el que los electrones se comparten desigualmente se denomina enlace covalente polar .
El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico
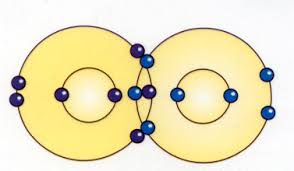
El término polar significa que hay separación de cargas. Un lado del enlace covalente es más negativo que el otro. Para ilustrar una molécula que tiene un enlace covalente polar, consideremos la molécula de ácido clorhídrico
Enlace covalente no polar
El hidrogeno es el primer elemento que presenta este tipo de enlace, por ejemplo cuando dos átomos comparten sus electrones, ambos adquieren la configuración del helio: 1s²
H + H --> H:H
Átomo de hidrogeno átomo de hidrogeno electrones compartidos
Se deduce entonces que un enlace covalente no polar, es aquel que se lleva acabo cuando se unen dos átomos iguales; y por lo mismo con la misma electronegatividad.
Ejemplo: el enlace covalente en le F2 cada átomo de flúor pose sus electrones propios y comparte otros dos, suficiente para completar los ocho que tiene el neón en su ultimo nivel energético. Los electrones más internos se omiten y solo se representa la compartición de los externos y se simplifica cuando únicamente se representa el enlace compartido por una línea de enlace.
Enlace quimico
Es la fuerza existente dos o mas átomos que los mantiene unidos en las moléculas.
Al producirse un acercamiento entre dos o mas átomos , puede darse una fuerza de atracción entre los electrones de los átomos y el núcleo de uno u otro atomo.

Al producirse un acercamiento entre dos o mas átomos , puede darse una fuerza de atracción entre los electrones de los átomos y el núcleo de uno u otro atomo.
Energia de ionizacion
Se define como la cantidad mínima de energía que hay que suministrar a un átomo neutro gaseoso y en estado fundamental para arrancarle el e- enlazado con menor fuerza, es decir, mide la fuerza con la que está unido el e- al átomo.
Es una energía muy elevada para los gases nobles y es necesaria una mayor cantidad de energía.
Las energías de ionización pequeña indican que los e- se arrancan con facilidad.
A medida que aumenta n el e- está más lejos del núcleo, la atracción es menor y por lo tanto, la energía de ionización es menor.
En el mismo periodo aumenta la carga nuclear y la energía de ionización tiene valores más grandes

Es una energía muy elevada para los gases nobles y es necesaria una mayor cantidad de energía.
Las energías de ionización pequeña indican que los e- se arrancan con facilidad.
A medida que aumenta n el e- está más lejos del núcleo, la atracción es menor y por lo tanto, la energía de ionización es menor.
En el mismo periodo aumenta la carga nuclear y la energía de ionización tiene valores más grandes
Afinidad electronica
La cantidad de energia que se libera cuando un atomo aislado se le adiciona un electron.
Se define como la variación de energía que tiene lugar cuando un átomo en estado gaseoso adquiere un e-.
Cuando el F adquiere un e- se libera energía, es un proceso exotérmico y la afinidad electrónica tiene un valor negativo.
Si el valor negativo es alto, estos átomos ganan con facilidad e-.
La afinidad electrónica y la energía de ionización varían igual en la tabla periódica.

Se define como la variación de energía que tiene lugar cuando un átomo en estado gaseoso adquiere un e-.
Cuando el F adquiere un e- se libera energía, es un proceso exotérmico y la afinidad electrónica tiene un valor negativo.
Si el valor negativo es alto, estos átomos ganan con facilidad e-.
La afinidad electrónica y la energía de ionización varían igual en la tabla periódica.

Radio atomico
Esta definido como mitad de la distancia entre dos núcleos de dos átomos adyacentes. Diferentes propiedades físicas, densidad, punto de fusión, punto de ebullición, estos están relacionadas con el tamaño de los átomos.


Electronegatividad
Es una medida de la fuerza de atracción que ejerce un átomo sobre los electrones de otro en un enlace covalente. Los diferentes valores de electronegatividad se clasifican según diferentes escalas, entre ellas la escala de Pauling y la escala de Mulliken.

En general, los diferentes valores de electronegatividad de los átomos determinan el tipo de enlace que se formará en la molécula que los combina. Así, según la diferencia entre las electronegatividades de éstos se puede determinar (convencionalmente) si el enlace será, según la escala de Linus Pauling:
- Iónico (diferencia superior o igual a 1.7)
- Covalente polar (diferencia entre 1.7 y 0.4)
- Covalente no polar (diferencia inferior a 0.4)

Nomenclatura
Nomenclatura Stock
Utiliza numeros romanos para determinar el numero de oxidacion con el cual se esta trabajando
Ejemplo:
CO2--- Oxido de carbono (IV)
CO---- Oxido de carbono (II)
Utiliza numeros romanos para determinar el numero de oxidacion con el cual se esta trabajando
Ejemplo:
CO2--- Oxido de carbono (IV)
CO---- Oxido de carbono (II)
Nomenclatura de los Oxidos Metalicos
Metales con numero de oxidacion fijo:
Fam. 1: Li, Na, K, Rb, Cs
Fam. 2: Be, Mg, Ca, Sr, Ba
Fam. 3: Sc, Y,
Zn, Al
Cd, Ga
Estos compuestos están formados por un metal (que solo posee un numero de oxidacion), el oxigeno, y la escritura correcta de acuerdo con Lupac consiste en colocar siempre del lado derecho el grupo funcional y del lado izquierdo el metal que participa.
Se antepone la palabra oxido seguida del metal y en este caso no es necesario especificar su numero de oxidacion.
Cs2O-- Oxido de cesio
Metales con numero de oxidaicion variable:
Para nombrar estos se utiliza el sistema de Ginebra y el sistema stock. La primera opcion conciste en agregar las terminaciones ico para el mayor numero de oxidacion y oso para el menor numero de oxidacion. Para ka segunda opcion, conciste en agregar un numero romano al final del nombre de oxidacion del metal.
EJEMPLO:
PbO...... Oxido plumboso, Oxido de Plomo (II)
Cr2O3.... Oxido cromoso, Oxido de Cromo (III)
Fe2O3.... Oxido ferrico, Oxido de Hierro (III)
Fam. 1: Li, Na, K, Rb, Cs
Fam. 2: Be, Mg, Ca, Sr, Ba
Fam. 3: Sc, Y,
Zn, Al
Cd, Ga
Estos compuestos están formados por un metal (que solo posee un numero de oxidacion), el oxigeno, y la escritura correcta de acuerdo con Lupac consiste en colocar siempre del lado derecho el grupo funcional y del lado izquierdo el metal que participa.
Se antepone la palabra oxido seguida del metal y en este caso no es necesario especificar su numero de oxidacion.
Cs2O-- Oxido de cesio
Metales con numero de oxidaicion variable:
Para nombrar estos se utiliza el sistema de Ginebra y el sistema stock. La primera opcion conciste en agregar las terminaciones ico para el mayor numero de oxidacion y oso para el menor numero de oxidacion. Para ka segunda opcion, conciste en agregar un numero romano al final del nombre de oxidacion del metal.
EJEMPLO:
PbO...... Oxido plumboso, Oxido de Plomo (II)
Cr2O3.... Oxido cromoso, Oxido de Cromo (III)
Fe2O3.... Oxido ferrico, Oxido de Hierro (III)
Para nombrar estos compuestos primero se nombra el oxigeno con terminacion ido, seguido del no metal, para leer los subindices del compuesto utilizamos los prefijos griegos:
# de atomos Prefijo griego
1.............................................Mono
2.............................................Di
3.............................................Tri
4.............................................Tetra
5.............................................Penta
6.............................................Hexa
7.............................................Epta
8.............................................Octa
9.............................................Nona
10...........................................DecaB2O3--- Trioxido de diboro
# de atomos Prefijo griego
1.............................................Mono
2.............................................Di
3.............................................Tri
4.............................................Tetra
5.............................................Penta
6.............................................Hexa
7.............................................Epta
8.............................................Octa
9.............................................Nona
10...........................................DecaB2O3--- Trioxido de diboro
Ácidos binarios
Para nombrar estos compuestos se antepone la palabra ácido mas el elemento (no metal) seguida de la palabra hidrico significa el hidrógeno en el agua.
Los ácidos son derivados del H
De acuerdo a la definición del arrenius un ácido es una sustancia que libera iones de hidrógeno (H) cuando se encuentra en solución acuosa
Para nombrar :
Ácido________hidrico
ácido sulfihidrio............H2S
ácido clorhidrico...........HCl
ácido yodhidrico...........HI
Cuando se encuentran en forma gaseosa se encuentran como derivados del H es decir el no metal tiene terminacion uro seguido de la palabra hidrógeno
Para nombrar estos compuestos se antepone la palabra ácido seguido del no metal y la terminacion:
hipo______oso.................valencia superior
_________oso
_________ico
per______ico.....................valencia inferior
ejemplo:
CIO: Hipo cloroso
CIO2: Cloroso
CIO3: Clorico
CIO4: Perclorico
Para nombrar estos compuestos se antepone la palabra ácido mas el elemento (no metal) seguida de la palabra hidrico significa el hidrógeno en el agua.
Los ácidos son derivados del H
De acuerdo a la definición del arrenius un ácido es una sustancia que libera iones de hidrógeno (H) cuando se encuentra en solución acuosa
Para nombrar :
Ácido________hidrico
ácido sulfihidrio............H2S
ácido clorhidrico...........HCl
ácido yodhidrico...........HI
Cuando se encuentran en forma gaseosa se encuentran como derivados del H es decir el no metal tiene terminacion uro seguido de la palabra hidrógeno
Para nombrar estos compuestos se antepone la palabra ácido seguido del no metal y la terminacion:
hipo______oso.................valencia superior
_________oso
_________ico
per______ico.....................valencia inferior
ejemplo:
CIO: Hipo cloroso
CIO2: Cloroso
CIO3: Clorico
CIO4: Perclorico
Para nombrar estos compuestos se utilizamos el ion poliatomico hidroxido seguido del metal correspondiente, y se siguen utilizando las mismas reglas de nomenclatura que se utlizaron para los oxidos metalicos
KOH.... Hidroxido de Potasio
Mg(OH)2... Hidroxido de magnesio
Pb(OH)4... Hidroxido de Plomo (IV) o Hidroxido Plumbico
Hg(OH)2... Hidroxido de magnesio (II)
KOH.... Hidroxido de Potasio
Mg(OH)2... Hidroxido de magnesio
Pb(OH)4... Hidroxido de Plomo (IV) o Hidroxido Plumbico
Hg(OH)2... Hidroxido de magnesio (II)
El atomo
En química y física, átomo (del latín atomum, y éste del griego ἄτομον, sin partes; también, se deriva de "a" no, y "tomo" divisible; no divisible) es la unidad más pequeña de un elemento químico que mantiene su identidad o sus propiedades y que no es posible dividir mediante procesos químicos.
El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
El concepto de átomo como bloque básico e indivisible que compone la materia del universo fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
Estructura de Lewis
Es una representacion grafica por medio de puntos o cruces la cual nos permite ver la distribucion de los electrones.



Ciclo del nitrogeno
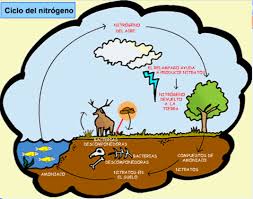
El Nitrógeno es un elemento increiblemente versátil que existe en forma inorgánica y orgánica, a la vez que en muchos y diferentes estados de oxidación. El movimiento del nitrógeno entre la atmósfera, la bioesfera y la geoesfera en sus diferentes formas está descrito en el ciclo del nitrógeno. Éste es uno de los ciclos biogeoquímicos más importantes. Al igual que el ciclo carbónico, el ciclo del nitrógeno consiste en varios bancos o bolsas de almacenamiento de nitrógeno y de procesos por los cuales las bolsas intercambian nitrógeno.
Los procesos principales que componen el ciclo del nitrógeno que pasa por la bioesfera, la atmósfera y la geoesfera son cinco: la fijación del nitrógeno, la toma de nitrógeno (crecimiento de organismos), la mineralización del nitrógeno (desintegracion), la nitrificación y la denitrificación. Los microorganismos, particularmente las bacterias, juegan un importante papel en todos las principales transformaciones del nitrógeno. Como procesos de mediación microbiales, estas transformaciones de nitrógeno ocurren generalmente más rápido que los procesos geológicos, tales como los movimientos de placas que es un proceso puramente físico que hace parte del ciclo carbónico. En el caso de los procesos de mediación microbianas, la velocidad se ve afectada por factores ambientales como la temperatura, la humedad y la disponibilidad de recursos que influyen la actividad microbiana.  NH4+ La fijación del nitrógeno es un proceso en el cual el N2 se convierte en amonio. Éste es esencial porque es la única manera en la que los organismos puede obtener nitrógeno directamente de la atmósfera. Algunas bacterias, por ejemplo las del género Rhizobium, son los únicos organismos que fijan el nitrógeno a través de procesos metabólicos. Esta simbiosis ocurre de manera bien conocida, en la familia de las legumbres (por ejemplo, fríjoles, arbejas y tréboles). En esta relación, la bacteria que fija el nitrógeno habita los nódulos de las raíces de las legumbres y reciben carbohidratos y un ambiente favorable de su planta anfitriona a cambio de parte del nitrógeno que ellas fijan. También hay bacterias que fijan el nitrógeno que existe, sin plantas anfitrionas. Éstas son conocidas como fijadores de nitrógeno libre sin límites. En ambientes acuáticos, las algas azules verdosas (en realidad una bacteria llamada cianobacteria) es una importante fijadora de nitrógeno libre sin límites.
NH4+ La fijación del nitrógeno es un proceso en el cual el N2 se convierte en amonio. Éste es esencial porque es la única manera en la que los organismos puede obtener nitrógeno directamente de la atmósfera. Algunas bacterias, por ejemplo las del género Rhizobium, son los únicos organismos que fijan el nitrógeno a través de procesos metabólicos. Esta simbiosis ocurre de manera bien conocida, en la familia de las legumbres (por ejemplo, fríjoles, arbejas y tréboles). En esta relación, la bacteria que fija el nitrógeno habita los nódulos de las raíces de las legumbres y reciben carbohidratos y un ambiente favorable de su planta anfitriona a cambio de parte del nitrógeno que ellas fijan. También hay bacterias que fijan el nitrógeno que existe, sin plantas anfitrionas. Éstas son conocidas como fijadores de nitrógeno libre sin límites. En ambientes acuáticos, las algas azules verdosas (en realidad una bacteria llamada cianobacteria) es una importante fijadora de nitrógeno libre sin límites.
Además del nitrógeno que fija la bacteria, eventos de alta energía natural, tales como los relámpagos, fuegos forestales, y hasta flujos de lava, pueden causar la fijación de pequeñas, pero significativas cantidades de nitrógeno. La alta energía de estos fenómenos naturales puede romper los enlaces triples de las moléculas de N2, haciendo alcanzables átomos individuales de N para la transformación química.
En el curso del último siglo, los humanos se han convertido en fuentes fijas de nitrógeno, tan importantes como todas las fuentes naturales de nitrógeno combinadas: quemando combustible de fósiles, usando fertilizantes nitrogenados sintéticos y cultivando legumbres que fijan nitrógeno . A través de estas actvidades, los humanos han duplicado la cantidad de nitrogeno fijada que se dispersa en la bioesfera cada año
 N Orgánico El amonio producido por el nitrógeno que fija la bacteria es usualmente incorporado rápidamente en la proteína y otros compuestos de nitrógeno orgánico, ya sea por la planta anfitriona, por la misma bacteria, o por otro organismo del suelo. Cuando los organismos más cercanos a lo alto de la cadena alimenticia (como nosotros!) comen, usan el nitrógeno que ha sido inicialmente fijado por el nitrógeno que fija la bacteria.
N Orgánico El amonio producido por el nitrógeno que fija la bacteria es usualmente incorporado rápidamente en la proteína y otros compuestos de nitrógeno orgánico, ya sea por la planta anfitriona, por la misma bacteria, o por otro organismo del suelo. Cuando los organismos más cercanos a lo alto de la cadena alimenticia (como nosotros!) comen, usan el nitrógeno que ha sido inicialmente fijado por el nitrógeno que fija la bacteria.
 NH4+ Después de que el nitrógeno se incorpora en la materia orgánica, frecuentemente se vuelve a convertir en nitrógeno inorgánico a través de un proceso llamado mineralización del nitrógeno, también conocido como desintegración. Cuando los organismos mueren, las materias de descomposición (como la bacteria y los hongos) consumen la materia orgánica y llevan al proceso de descomposición. Durante este proceso, una cantidad significativa del nitrógeno contenido dentro del organismo muerto se convierte en amonio. Una vez que el nitrógeno está en forma de amonio, está también disponible para ser usado por las plantas o para transformaciones posteriores en nitrato (NO3-) a través del proceso llamado nitrificación.
NH4+ Después de que el nitrógeno se incorpora en la materia orgánica, frecuentemente se vuelve a convertir en nitrógeno inorgánico a través de un proceso llamado mineralización del nitrógeno, también conocido como desintegración. Cuando los organismos mueren, las materias de descomposición (como la bacteria y los hongos) consumen la materia orgánica y llevan al proceso de descomposición. Durante este proceso, una cantidad significativa del nitrógeno contenido dentro del organismo muerto se convierte en amonio. Una vez que el nitrógeno está en forma de amonio, está también disponible para ser usado por las plantas o para transformaciones posteriores en nitrato (NO3-) a través del proceso llamado nitrificación.
 NO3- Parte del amonio producido por la descomposición se convierte en nitrato a través de un proceso llamado nitrificación. Las bacterias que llevan a cabo esta reacción obtienen energía de sí misma. La nitrificación requiere la presencia del oxígeno. Por consiguiente, la nitrificación puede suceder sólamente en ambientes ricos de oxígeno, como las aguas que circulan o que fluyen y las capas de la superficie de los suelos y sedimentos. El proceso de nitrificación tiene algunas importantes consecuencias. Los iones de amonio tienen carga positiva y por consiguiente se pegan a partículas y materias orgánicas del suelo que tienen carga negativa. La carga positiva previene que el nitrógeno de amonio sea barrido (o lixiviado) del suelo por las lluvias. Por otro lado, el ión de nitrato con carga negativa no se mantiene en las partículas del suelo y puede ser barrido del perfil de suelo. Esto lleva a una disminución de la fertilidad del suelo y a un enriquecimiento de nitrato de las aguas corrientes de la superficie y del subsuelo.
NO3- Parte del amonio producido por la descomposición se convierte en nitrato a través de un proceso llamado nitrificación. Las bacterias que llevan a cabo esta reacción obtienen energía de sí misma. La nitrificación requiere la presencia del oxígeno. Por consiguiente, la nitrificación puede suceder sólamente en ambientes ricos de oxígeno, como las aguas que circulan o que fluyen y las capas de la superficie de los suelos y sedimentos. El proceso de nitrificación tiene algunas importantes consecuencias. Los iones de amonio tienen carga positiva y por consiguiente se pegan a partículas y materias orgánicas del suelo que tienen carga negativa. La carga positiva previene que el nitrógeno de amonio sea barrido (o lixiviado) del suelo por las lluvias. Por otro lado, el ión de nitrato con carga negativa no se mantiene en las partículas del suelo y puede ser barrido del perfil de suelo. Esto lleva a una disminución de la fertilidad del suelo y a un enriquecimiento de nitrato de las aguas corrientes de la superficie y del subsuelo.
 N2+ N2O A través de la denitrificación, las formas oxidadas de nitrógeno como el nitrato y el nitrito (NO2-) se convierten en dinitrógeno (N2) y, en menor medida, en gas óxido nitroso. La denitrificación es un proceso anaeróbico llevado a cabo por la bacteria que denitrifica, que convierte el nitrato en dinitrógeno en la siguiente secuencia:
N2+ N2O A través de la denitrificación, las formas oxidadas de nitrógeno como el nitrato y el nitrito (NO2-) se convierten en dinitrógeno (N2) y, en menor medida, en gas óxido nitroso. La denitrificación es un proceso anaeróbico llevado a cabo por la bacteria que denitrifica, que convierte el nitrato en dinitrógeno en la siguiente secuencia:
NO3- NO2-
NO2-  NO
NO  N2O
N2O  N2.
N2.
El óxido nítrico y el óxido nitroso son gases importantes para el ambiente. El óxido nítrico (NO) contribuye a formar smog, y el óxido nitroso (N2O) es un gas de invernadero importante, por lo que contribuye a los cambios globales climatológicos.
Una vez que se conviete en dinitrógeno, el nitrógeno tiene pocas posibilidades de reconvertirse en una forma biológica disponible, ya que es un gas y se pierde rapidamente en la atmósfera. La denitrificación es la única trasformación del nitrógeno que remueve el nitrógeno del ecosistema (que es esencialmente irreversible), y aproximadamente balancea la cantidad de nitrógeno fijado por los fijadores de nitrógeno descritos con anterioridad.
| |
La Fijación del Nitrógeno
N2 Además del nitrógeno que fija la bacteria, eventos de alta energía natural, tales como los relámpagos, fuegos forestales, y hasta flujos de lava, pueden causar la fijación de pequeñas, pero significativas cantidades de nitrógeno. La alta energía de estos fenómenos naturales puede romper los enlaces triples de las moléculas de N2, haciendo alcanzables átomos individuales de N para la transformación química.
En el curso del último siglo, los humanos se han convertido en fuentes fijas de nitrógeno, tan importantes como todas las fuentes naturales de nitrógeno combinadas: quemando combustible de fósiles, usando fertilizantes nitrogenados sintéticos y cultivando legumbres que fijan nitrógeno . A través de estas actvidades, los humanos han duplicado la cantidad de nitrogeno fijada que se dispersa en la bioesfera cada año
La toma del Nitrógeno
NH4+La Mineralización del Nitrógen
El N OrgánicoNitrificación
NH4+La Denitrificación
NO3-NO3-
El óxido nítrico y el óxido nitroso son gases importantes para el ambiente. El óxido nítrico (NO) contribuye a formar smog, y el óxido nitroso (N2O) es un gas de invernadero importante, por lo que contribuye a los cambios globales climatológicos.
Una vez que se conviete en dinitrógeno, el nitrógeno tiene pocas posibilidades de reconvertirse en una forma biológica disponible, ya que es un gas y se pierde rapidamente en la atmósfera. La denitrificación es la única trasformación del nitrógeno que remueve el nitrógeno del ecosistema (que es esencialmente irreversible), y aproximadamente balancea la cantidad de nitrógeno fijado por los fijadores de nitrógeno descritos con anterioridad.
Reaccion quimica
Reaccion quimica
Procesos en las que una o mas sustancias se transforman en otra y otras con propiedades diferentes. Para que pueda existir una RQ deben haber sustancias que reaccionan y sustancias que se forman. Se denominara reaccionante o reactivo a la sustancia que reacciona. Alas sustancias que se generan se les denomina sustancia resultante o producto quimico.
Tipos de reaccion
-Descomposicion
-Doble conbinacion
-Oxidacion
-Reduccion
-Acido-base
-Sustancia-simple
-Sustancia-doble
Reaccion exotermica
Se desprende energia en el curso de la reaccion
Reaccion endotermica
Se absorve energia durante el curso de la reaccion


Procesos en las que una o mas sustancias se transforman en otra y otras con propiedades diferentes. Para que pueda existir una RQ deben haber sustancias que reaccionan y sustancias que se forman. Se denominara reaccionante o reactivo a la sustancia que reacciona. Alas sustancias que se generan se les denomina sustancia resultante o producto quimico.
Tipos de reaccion
-Descomposicion
-Doble conbinacion
-Oxidacion
-Reduccion
-Acido-base
-Sustancia-simple
-Sustancia-doble
Reaccion exotermica
Se desprende energia en el curso de la reaccion
Reaccion endotermica
Se absorve energia durante el curso de la reaccion
miércoles, 6 de octubre de 2010
LEY DE PROUST
En 1808 Proust llego a la conclucion que paraformar un determinado compuesto, dos o mas elementos quimicos se unen en la misma proporcion ponderal.
La naturaleza nunca va a alterar su composicion original.

La naturaleza nunca va a alterar su composicion original.
COLOIDES Y SUSPENCIONES
COLOIDES
es un sistema físico-químico formado por dos o más fases, principalmente éstas son: una continua, normalmente fluida, y otra dispersa en forma de partículas; por lo general sólidas.
La fase dispersa es la que se halla en menor proporción.
El nombre de coloide proviene de la raíz griega kolas que significa que puede pegarse. Este nombre hace referencia a una de las principales propiedades de los coloides: su tendencia espontánea a agregar o formar coágulos.
Aunque el coloide por excelencia es aquel en el que la fase continua es un líquido y la fase dispersa se compone de partículas sólidas, pueden encontrarse coloides cuyos componentes se encuentran en otros es
tados de agregación.
SUSPENCIONES
son mezclas heterogéneas formadas por un sólido en polvo (soluto) o pequeñas partículas no solubles (fase dispersa) que se dispersan en un medio líquido o gaseoso (fase dispersante o dispersora). Cuando uno de los componentes es agua y los otros son sólidos suspendidos en la mezcla, son conocidas como suspensiones mecánicas.
Ejemplos de suspensiones son:
es un sistema físico-químico formado por dos o más fases, principalmente éstas son: una continua, normalmente fluida, y otra dispersa en forma de partículas; por lo general sólidas.
La fase dispersa es la que se halla en menor proporción.
El nombre de coloide proviene de la raíz griega kolas que significa que puede pegarse. Este nombre hace referencia a una de las principales propiedades de los coloides: su tendencia espontánea a agregar o formar coágulos.
Aunque el coloide por excelencia es aquel en el que la fase continua es un líquido y la fase dispersa se compone de partículas sólidas, pueden encontrarse coloides cuyos componentes se encuentran en otros es
| Fase dispersa | ||||
|---|---|---|---|---|
| Fase continua | Gas | No es posible porque todos los gases son solubles entre sí | Aerosol líquido,Ejemplos: niebla, bruma | Aerosol sólido,Ejemplos: Humo, polvo en suspensión |
| Líquido | Espuma,Ejemplos: Espuma de afeitado | Emulsión,Ejemplos: Leche, salsa mayonesa, crema de manos, sangre | Sol,Ejemplos: Pinturas, tinta china | |
| Sólido | Espuma Sólida,Ejemplos: piedra Pómez, Aerogeles | Gel,Ejemplos: Gelatina, gominola, queso | Sol sólido,Ejemplos: Cristal de Rubí | |
tados de agregación.
SUSPENCIONES
son mezclas heterogéneas formadas por un sólido en polvo (soluto) o pequeñas partículas no solubles (fase dispersa) que se dispersan en un medio líquido o gaseoso (fase dispersante o dispersora). Cuando uno de los componentes es agua y los otros son sólidos suspendidos en la mezcla, son conocidas como suspensiones mecánicas.
Características
Las suspensiones presentan las siguientes características: MLP m.- Sus partículas son mayores que las de las disoluciones y los coloides, lo que permite observarlas a simple vista.
- Sus partículas se sedimentan si la suspensión se deja en reposo.
Ejemplos de suspensiones son:
- algunos medicamentos;
- agua y la arena;
- la arena mezclada con el cemento;
- refrescos elaborados con zumos de frutas;
- algunas pinturas vinílicas.
- algunos aerosoles, especialmente aquellos que requieren ser agitados antes de usarse.
- el aceite diluido con el agua.
| Fase dispersa | ||||
|---|---|---|---|---|
| Fase continua | Gas | No es posible porque todos los gases son solubles entre sí | Aerosol líquido,Ejemplos: niebla, bruma | Aerosol sólido,Ejemplos: Humo, polvo en suspensión |
| Líquido | Espuma,Ejemplos: Espuma de afeitado | Emulsión,Ejemplos: Leche, salsa mayonesa, crema de manos, sangre | Sol,Ejemplos: Pinturas, tinta china | |
| Sólido | Espuma Sólida,Ejemplos: piedra Pómez, Aerogeles | Gel,Ejemplos: Gelatina, gominola, queso | Sol sólido,Ejemplos: Cristal de Rubí | |
Suscribirse a:
Entradas (Atom)
